El 24 de febrero de 2019 fue publicado en Journal of Electrophysiology un artículo sobre el papel del haz septopulmonar en el aleteo (flutter) auricular (AA) dependiente del techo de la aurícula izquierda con un componente epicárdico. En él se presentan dos casos en los cuáles no se logró le resolución de la arritmia a pesar del aislamiento de la pared posterior.
La ablación por catéter o quirúrgica de la fibrilación auricular puede predisponer a los pacientes al desarrollo de aleteos auriculares atípicos. Cuando se sospecha de dicha macroentrada, el mapeo de la activación del impulso y las maniobras de entrainment (encarrilamiento) son útiles para delinear el circuito de arritmia y planear una estrategia de ablación que implique la interrupción del istmo crítico mediante la creación de líneas de bloqueo entre dos barreras anatómicas.
Sin embargo, a veces dicha taquicardia no termina a pesar de un diagnóstico aparentemente correcto y una estrategia de ablación cuidadosa. En esos casos se debe reconsiderar la precisión del diagnóstico inicial y descartar la transición a un circuito diferente, pero también se debe regresar a la anatomía y considerar la existencia de haces musculares epicárdicos distintos, separados anatómicamente, que pueden tener un papel en las arritmias de reentrada auricular.
Se describen en este trabajo 2 casos de aleteo auricular dependientes del techo que no terminaron intraprocedimiento a pesar del aislamiento de la pared posterior endocárdica en uno y que aparecieron después del aislamiento anterior de la pared posterior en el segundo.
Este “fracaso” determinó que se sospechara la presencia de un componente epicárdico que involucraba el haz septopulmonar (HSP). En el trabajo se muestran los mapas de activación/entrainment y el enfoque de la ablación realizado en cada caso. Además, se describió la correlación entre los hallazgos electrofisiológicos y el sustrato anatómico.
Nos recuerdan los autores que el papel de las conexiones interauriculares y las fibras epicárdicas en las arritmias de reentrada auricular ha sido cada vez más reconocido. La vena de Marshall puede proporcionar conexiones epicárdicas entre el seno coronario y la aurícula izquierda, evitando el istmo mitral y explicando la ablación fallida de aleteos perimitrales.
El haz de Bachmann (HB), un haz paralelo de fibra miocárdicas que se extiende de forma subepicárdica a través del surco interauricular, es la vía principal de la conducción interatrial entre las aurículas derecha e izquierda y se ha informado que es el sustrato para algunos aleteos biatriales.
Además, el haz intercavo, que conecta la aurícula derecha o la vena cava superior con la vena pulmonar superior derecha, puede dificultar el aislamiento de dicha vena pulmonar y hacer que sea necesario realizar la ablación en la carina de la vena pulmonar correcta o desde la aurícula derecha.
En los dos casos de AA dependiente del techo que persistieron después del aislamiento endocárdico de la pared posterior presentados, se confirmó el bloqueo de entrada endocárdico al no demostrar electrogramas de alta frecuencia o actividad disociada dentro de las venas pulmonares y la pared posterior. Además, el bloqueo de salida se documentó por ausencia de captura cuando se estimuló a 10 mA / 2.0 ms desde ambas estructuras. A pesar de esta documentación, en ambos casos, el mapeo de la activación y del entrainment, fue posible estimulando a 50mA / 2 ms, proporcionando evidencia de conducción a través del aspecto epicárdico de la pared posterior. (ver figura)
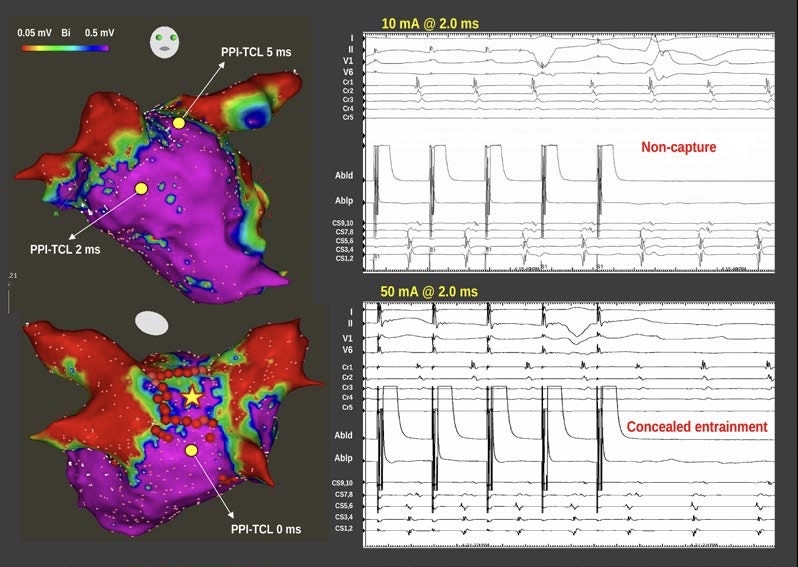
La posibilidad de un AA dependiente del techo a pesar del aislamiento endocárdico de la pared posterior implica la disociación entre la actividad eléctrica en el endocardio (electrogramas ausentes o disociadas) y el epicardio (AA sostenido). Esta disociación eléctrica entre endo y epicardio podría ser favorecida por la arquitectura muscular de dos capas de la aurícula izquierda, como lo describió James Papez en 1920. Con disecciones detalladas de la pared de la aurícula izquierda, este autor informó sobre la existencia de un amplio grupo de fibras subepicárdicas que surgen del surco interauricular por debajo de HB, pasan principalmente en orientación longitudinal y descienden en la pared posterior entre los orificios de las venas pulmonares derecha e izquierda. Estos fascículos musculares fueron denominados por Papez como haz septopulmonar (HSP).
El mismo autor también describió un haz de fibras dispuestas más profundamente que el SPB, formando el subendocardio auricular izquierdo, el “haz septoatrial” (HSA). Este haz se origina en el rafe interauricular anterior, asciende de forma oblicua y se combina con las fibras longitudinales del vestíbulo anterior para pasar entre las VPs izquierda y derecha en la pared posterior.
Esta arquitectura bicapa ha sido confirmada posteriormente por otros autores y, más recientemente, mediante el uso de técnicas de imágenes de resonancia magnética, que permiten la reconstrucción en 3D de las fibras musculares de todo el corazón humano intacto a una resolución submilimétrica. A pesar de que se ha informado de cierta variabilidad de la arquitectura muscular en las aurículas humanas, su disposición de dos capas en la aurícula izquierda se describe de manera consistente en la literatura publicada. Estas capas no están separadas por vainas de tejido fibroso aislante, lo que hace probable que el aislamiento de la pared posterior afecte el endocardio a nivel del HSA y también sea parte del HSP con la preservación de sus fibras más epicárdicas para sostener el AA dependiente del techo, tal como los casos presentados aquí.
Según consideran los autores este es el primer informe que describe esta observación que tiene implicaciones importantes. Primero, demuestra que a pesar de la ablación lineal endocárdica con bloqueo bidireccional demostrado en la pared posterior, la conducción puede continuar en el epicardio, lo que sugiere una falta de transmuralidad en el conjunto de lesiones del área.
En segundo lugar, esta falta de transmuralidad podría explicar la recurrencia de arritmia después de una ablación extensa de FA que incluye aislamiento de venas pulmonares y pared posterior.
En tercer lugar, la prueba del bloqueo bidireccional basado en la eliminación de electrogramas locales de alta frecuencia sin captura a 10 mA / 2 ms posiblemente no sea un sustituto preciso del efecto transmural, al menos en la pared posterior. El uso de estimulación a 50 mA / 2ms dentro del área de la pared posterior puede ser un método más preciso para demostrar el verdadero bloqueo de salida.
Sin embargo, este punto final requerirá una ablación más agresiva en la pared posterior que debe ser equilibrada con los riesgos de daño colateral, especialmente la lesión esofágica, y sugiere la necesidad de estudios bien diseñados para demostrar la incidencia y el impacto clínico de las conexiones epicárdicas de la pared posterior.
En los 2 pacientes informados aquí, no fue necesario un enfoque de ablación epicárdica y el circuito se interrumpió al colocar una nueva línea de ablación caudal a la línea del piso inicial o después de ablacionar todos los lugares que muestran electrogramas de campo lejano con captura a la salida / duración más alta dentro del área.
El suministro de una ablación complementaria a lo largo de las mismas líneas originales mediante el uso de mayor potencia para una duración más prolongada podría ser un enfoque alternativo, pero el riesgo de lesión esofágica también podría aumentar.
En conclusión, se puede sospechar un componente epicárdico que involucra el HSP cuando el mapeo es compatible con un AA dependiente del techo, pero no se logra ninguna terminación con el aislamiento aparente de la pared posterior.
El diagnóstico se puede realizar mediante una estimulación de alto rendimiento en el área de pared posterior, lo que dará como resultado una aceleración del aleteo estimulado con entrainment intracardíaco oculto.
* Garcia F, Enriquez A, Arroyo A, Supple G, Marchlinski F, Saenz L. Roof-dependent atrial flutter with an epicardial component: Role of the septopulmonary bundle. J Cardiovasc Electrophysiol. 2019 Feb 24. doi: 10.1111/jce.13885. [Epub ahead of print]